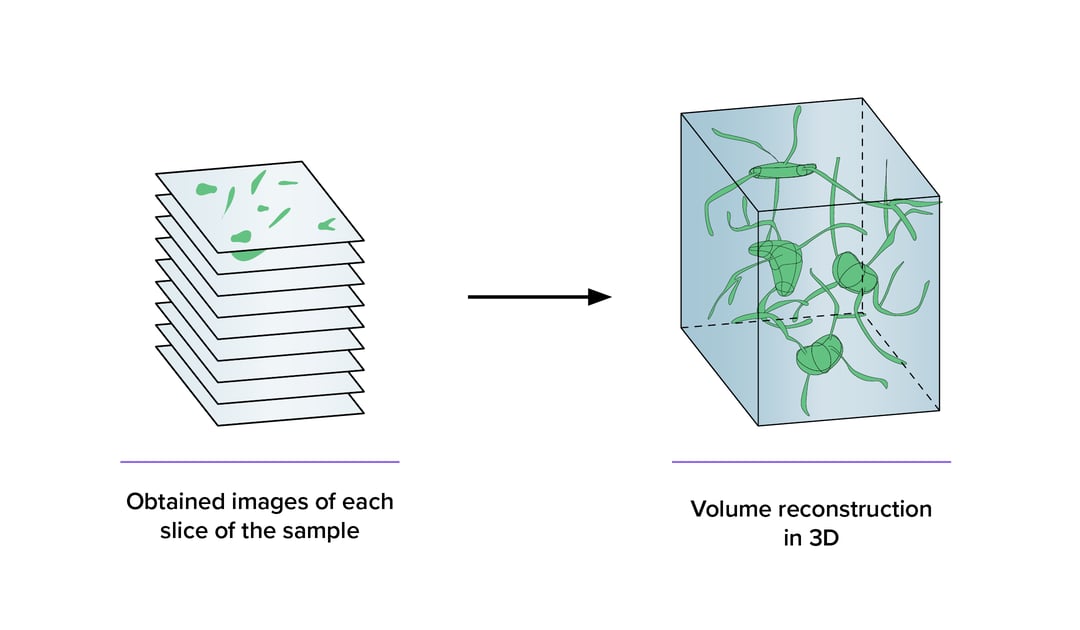
众所周知,生物是高度复杂的三维事物,因此捕获生物体细胞结构的3D图像对于了解细胞结构与功能之间的关系至关重要。
然而,大多数现有的成像技术只能产生2D图像,这使得3D数据重建工作的展开十分困难。而如今,各种各样的3D成像技术逐步得以实现。
一些光学显微镜可以获取细胞结构的3D图像,并提供有关细胞和组织中结构功能关系的有价值的信息。然而,光学显微镜技术存在着需要化学标记物的缺陷。由于标记物是针对靶标的,因此十分有限,同时标记物的开发既困难又乏味。
扫描电子显微镜(SEM)却可以克服这些缺点[1]。但是,未经修改的传统扫描电镜无法捕获3D信息。此外,具有数百个薄片的样本连续切片极大地增加了样本处理时间。这些缺点催化处理对软件和硬件进行改进的想法,以自动方式捕获3D信息。最终诞生了以下自动扫描电镜方法:串行块面扫描电镜(SBEM),聚焦离子束扫描电镜(FIB-SEM)和阵列层析成像[2]。这些扫描电镜技术之间的主要区别是实现连续切片的方式。 串行块面扫描电镜使用集成在真空室中的超薄切片机,在用电子束扫描表面后,切片机会自动从样本上去除一部分。 聚焦离子束扫描电镜中采用了类似的方法,但是不是使用金刚石刀来曝光新表面,而是使用聚焦离子束。而阵列层析成像将样本的切片收集在诸如晶片的导电基材上,然后在扫描电镜中成像。这样的好处是可以保留样本完整,以便之后进行重新成像,而串行块面扫描电镜和聚焦离子束扫描电镜在成像过程中会破坏样本。
这些扫描电镜技术都很有挑战性,需要大量经验。最重要的是,用单个电子束获取大量样本的数据非常耗时。例如,在神经生物学中,收集在像老鼠这样的小生物中绘制所有神经元连接图所需的电镜数据将需要花费数年的时间[3]。因此,研究者们对扫描电镜的速度有很高的要求, 而解决方案之一就是使用能够同时用多个电子束成像的扫描电镜。Delmic目前正在开发这种多光束解决方案,其中扫描电镜与光透射检测器结合在一起。这种扫描透射电子显微镜的方法可以对纳米级分辨率的大体积生物样本进行快速可靠的成像。
由于研究者们对了解生物过程和功能的超微结构细节的大量需求,体电子显微镜具有广泛的应用。例如,在植物生理学中,将分子的作用分配给相应的基因并确定它们在植物过程和结构中的总体贡献非常重要[4]。因此,我们可以将获得的有关结构差异的数据与可用的基因组数据一起进行分析,以破译超结构环境中的遗传或功能数据。体视显微镜还被发现可应用于组织病理学中用于诊断目的的分析组织结构的研究中 [5]。
总之,体电子显微镜是一种有价值的工具,有助于揭示生物系统的复杂结构功能关系。Delmic旨在尽力发展在操作员最少干预的前提下,提供稳定、自动化的工作流程。我们的目标是使体电子显微镜技术得以应用于更多的研究领域,例如,生物膜分析、食品工程和诊断学。
想了解有关超快体电子显微镜和Delmic解决方案的更多信息,欢迎访问超快体电镜基本原理页面。
References
[1] C. J. Peddie and L. M. Collinson, “Exploring the third dimension: Volume electron microscopy comes of age,” Micron, vol. 61, pp. 9–19, 2014, doi: 10.1016/j.micron.2014.01.009.
[2] B. Titze and C. Genoud, “Volume scanning electron microscopy for imaging biological ultrastructure,” Biol. Cell, vol. 108, no. 11, pp. 307–323, 2016, doi: 10.1111/boc.201600024.
[3] K. L. Briggman and D. D. Bock, “Volume electron microscopy for neuronal circuit reconstruction,” Curr. Opin. Neurobiol., vol. 22, no. 1, pp. 154–161, 2012, doi: 10.1016/j.conb.2011.10.022.
[4] W. Shen et al., “Three-dimensional reconstruction of Picea wilsonii Mast. pollen grains using automated electron microscopy,” Sci. China Life Sci., vol. 63, no. 2, pp. 171–179, 2020, doi: 10.1007/s11427-019-9820-4.
[5] N. Roberts et al., “Toward Routine Use of 3D Histopathology as a Research Tool,” Biophys. Imaging Comput. Biol., vol. 180, no. 5, pp. 1835–1842, 2012, doi: 10.1016/j.ajpath.2012.01.033.
.png)